2023年1月2日
2023年1月2日,傳奇生物(NASDAQ:LEGN)在中國南京正式宣布,公司首款自主研發的細胞治療產品西達基奧侖賽注射液(Ciltacabtagene Autoleucel,研究代碼LCAR-B38M細胞制劑)新藥上市申請(NDA)已獲得國家藥品監督管理局(NMPA)正式受理。
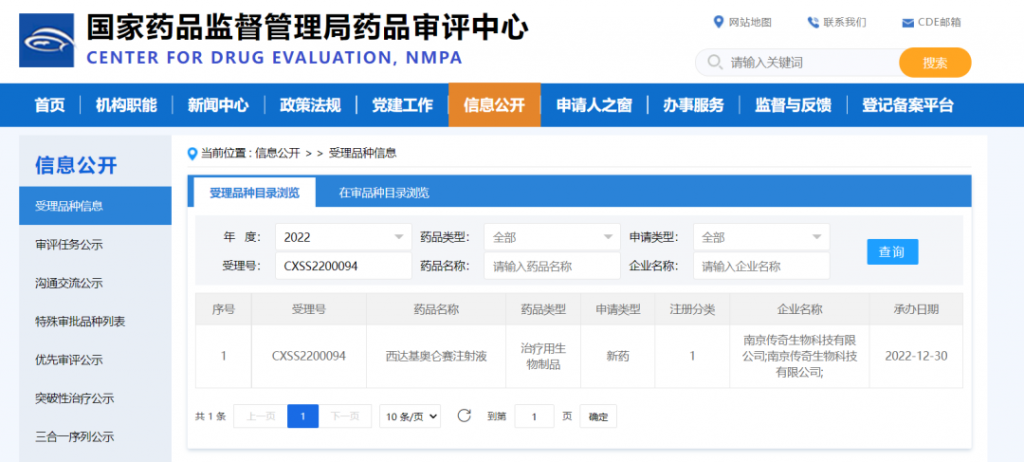
西達基奧侖賽注射液是一種靶向B細胞成熟抗原(BCMA)經嵌合抗原受體基因修飾的自體T細胞產品 (CAR-T細胞),以一次性輸注給藥。西達基奧侖賽于2018年3月獲得國家藥品監督管理局首個CAR-T細胞產品臨床試驗申請(IND)批件,并于2020年8月成為首個納入中國突破性治療藥物程序的品種。
此次遞交是基于在中國開展的確證性臨床研究CARTIFAN-1(NCT03758417/CTR20181007)結果,證實了西達基奧侖賽為復發或難治性多發性骨髓瘤患者帶來了臨床獲益。該研究評估了西達基奧侖賽在既往接受過至少3線治療包括一種蛋白酶體抑制劑(PI)和一種免疫調節劑(IMiD)后復發或難治性多發性骨髓瘤(R/R MM)成人患者中的有效性及安全性。
中國血液病學家和分子遺傳學家、中國工程院院士、CARTIFAN-1臨床試驗主要研究者陳賽娟表示:“多發性骨髓瘤是中國第二大常見的惡性血液腫瘤,高發于中老年人群。據統計,2020年中國多發性骨髓瘤年齡標準化發病率約為1.15/10萬人1。隨著我國進入老齡化社會,發病率已明顯上升,且發病年齡趨于年輕化。盡管近年來患者的生存期已得到顯著改善,但很多患者確診時已是晚期,多數在初始治療后會復發,且預后較差,該疾病目前仍不可治愈,存在巨大未被滿足的臨床需求,他們亟需一種更為有效的治療手段。根據在我國開展的CARTIFAN-1確證性臨床試驗數據顯示,西達基奧侖賽在復發或難治性多發性骨髓瘤患者中顯示了持久且深度的獲益。我們期待這款CAR-T細胞治療新藥盡早獲批,惠及更多患者。”
傳奇生物首席執行官黃穎博士表示:“滿足臨床需求,服務于包括中國患者在內的全球患者一直是傳奇生物創新研發的初衷。目前,西達基奧侖賽已在美國、歐洲和日本獲批上市。作為誕生于中國的原創新藥,此次西達基奧侖賽的上市申請獲得國家藥監局的正式受理具有特殊的重要意義。我們期待這款療效顯著的產品能在中國早日獲批上市,為中國多發性骨髓瘤患者提供新的治療選擇,帶來更多治愈的希望。”
關于西達基奧侖賽(Ciltacabtagene Autoleucel)
西達基奧侖賽是一種靶向B細胞成熟抗原 (BCMA) 的嵌合抗原受體 T 細胞 (CAR-T) 產品,使用嵌合抗原受體 (CAR) 的轉基因對患者自身的T細胞進行修飾,以識別和消除表達BCMA的細胞。BCMA主要表達于惡性多發性骨髓瘤B細胞、晚期B細胞和漿細胞的表面。西達基奧侖賽的CAR蛋白具有兩種BCMA靶向單域抗體,對表達BCMA的細胞具有高親和力,在與BCMA表達細胞結合后,CAR可促進T細胞活化、擴增,繼而清除靶細胞。
2017年12月,楊森與傳奇生物簽訂了全球獨家許可和合作協議,以研發和商業化西達基奧侖賽。2020年8月,西達基奧侖賽獲得中國首個“突破性治療藥物”資格認證,2019年4月獲得了歐盟委員會的優先藥物 (PRIME) 指定,2019年12月被美國FDA授予突破性療法認定。美國FDA 、歐洲EMA和日本PMDA分別于2019年2月、2020年2月和2020年6月授予西達基奧侖賽孤兒藥資格認定。2022年2月,西達基奧侖賽獲得美國食品藥品監督管理局(FDA)批準,商品名CARVYKTI?,5月獲得歐盟委員會 (EC) 附條件上市許可,9月獲得日本厚生勞動省(MHLW)批準上市,用于治療成人復發或難治性多發性骨髓瘤。
關于CARTIFAN-1
CARTIFAN-1 (NCT03758417) 是一項2期開放、確證性試驗,用于評估西達基奧侖賽治療中國復發或難治性多發性骨髓瘤(R/R MM)患者的療效和安全性,這些患者既往至少接受過3線治療,包括蛋白酶體抑制劑和免疫調節劑,主要研究終點為總緩解率。
關于多發性骨髓瘤
多發性骨髓瘤 (Multiple Myeloma, MM) 被認為是不可治愈的血液腫瘤,是由于骨髓中的漿細胞過度增殖導致的惡性疾病。根據世界衛生組織最新數據,2020年中國有超過21000例新病例和近16200例由于多發性骨髓瘤導致的死亡病例2。雖然有些多發性骨髓瘤患者無明顯癥狀,但大多數患者是由于出現癥狀而被確診,這些癥狀可能包括骨病、低血細胞計數異常、血鈣升高、腎臟問題或感染等。雖然經過治療可能會有一些緩解,但不幸的是,患者很可能會復發。使用標準療法(包括蛋白酶抑制劑、免疫調節劑和抗CD38單克隆抗體)治療后復發的患者會面臨預后不佳,治療手段受限的問題。
關于傳奇生物
傳奇生物(NASDAQ:LEGN)成立于2014年,是一家集腫瘤免疫細胞療法研發、臨床、生產及商業化開發于一體的跨國生物制藥公司,位列全球免疫細胞療法領域第一方陣,全球員工總數已逾1000人。目前通過與楊森的合作,首款產品CARVYKTI?已于2022年獲得美國食品藥品監督管理局(FDA)、日本厚生勞動省(MHLW)批準上市,并獲得歐盟委員會(EC)附條件上市許可,有望解決多發性骨髓瘤治療的世界級難題。此外,公司還有多款在研細胞療法,用于血液瘤、實體瘤及其它疑難疾病的治療。公司先后榮獲“中國生物醫藥產業鏈創新風云榜鯤鵬獎”、“中國醫藥創新企業100強”、“南京市引才用才示范企業金梧桐獎”、“《麻省科技評論》50家聰明公司”、“最具影響力創新療法企業TOP20”等榮譽。更多信息請訪問:www.www.svcnd.com
參考文獻:
[1]Wang S, Xu L, Feng J, Liu Y, Liu L, Wang J, Liu J, Huang X, Gao P, Lu J and Zhan S (2020) Prevalence and Incidence of Multiple Myeloma in Urban Area in China: A National Population-Based Analysis. Front. Oncol. 9:1513. doi: 10.3389/fonc.2019.01513https://www.frontiersin.org/articles/10.3389/fonc.2019.01513/full
[2] Globocan 2020 World Fact Sheet: China.https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf. Accessed June 2021.
傳奇生物公布2024年第四季度和全年業績及近期亮點
2025年3月11日
2024 ASH | 與標準治療相比,CARVYKTI? 顯著提高了復發或難治性多發性?..
2024年12月10日
傳奇生物公布2024年第三季度業績及近期亮點
2024年11月12日
精彩預告 | 傳奇生物CARTITUDE-4最新研究成果即將亮相2024ASH年會
2024年11月5日
傳奇生物任命Alan Bash為CARVYKTI?總裁
2024年11月4日
傳奇生物在費城新建先進的細胞治療研發設施
2024年10月3日
